Remodelamento Cardíaco
É o termo utilizado para descrever as alterações funcionais, estruturais, miocelulares e intersticiais que ocorrem em resposta à lesão miocárdica causada por ativação neuro-hormonal, aumento do estresse da parede e vias de sinalização inflamatória, levando à insuficiência Cardíaca (IC). Clinicamente se manifesta por alterações no tamanho, massa, geometria e função do coração.
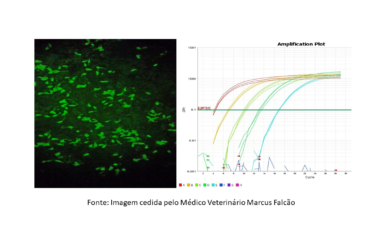
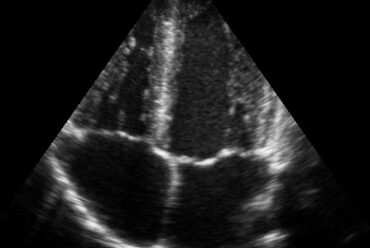
O remodelamento do VE provoca mudanças no diâmetro, massa (hipertrofia ou atrofia), geometria (espessura das paredes e forma da cavidade), fibrose ou infiltrado inflamatório (miocardites). Os métodos utilizados para detectar essas mudanças são a ecocardiografia, a ventriculografia e a ressonância magnética cardíaca. Outras formas de diagnóstico, ainda não utilizadas na rotina clínica, são a detecção de marcadores celulares que manifestam a mudança de expressão de alguns genes que modificam as cadeias da proteínas contráteis, alterando as condições bioquímicas celulares.
A principal consequência do remodelamento patológico é a disfunção miocárdica, marcando o início e a progressão da disfunção ventricular, que começa com mudanças genéticas em resposta ao dano cardíaco, provocando alterações celulares e moleculares que levam à perda progressiva da função ventricular, assintomática primeiro, evoluindo depois para sintomas e sinais de insuficiência cardíaca.
Os eventos começam com o dano miocárdico, que pode ser causado por apoptose (morte celular) de miócito, por inflamação, por causas tóxicas, por mudanças genéticas, por sobrecargas pressóricas volumétricas.
O remodelamento miocárdico pode-se associar com arritmias malignas, como taquicardia ventricular sustentada e fibrilação ventricular. O aumento do colágeno, nos três compartimentos miocárdicos (epimísio, que envolve todas as fibras musculares, perimísio, que envolve feixes menores de miócitos e endomísio, que separa os próprios miócitos) provocando fibrose, bloqueia os estímulos elétricos, diminui a velocidade de transmissão dos impulsos, aumenta o tempo de período refratário e pode promover fenômenos de reentrada que provocam arritmias.
Com a ecocardiografia pode-se ser determinada a denominada heterogeneidade elétrica, provocada pelas áreas de fibrose e pode ser detectado pela ecocardiografia com strain longitudinal, pela variação do tempo de deformação de cada segmento miocárdico.
O remodelamento miocárdico também modifica uma das principais proteínas contráteis, a miosina, composta por dois pares de cadeias pesadas e por dois pares de cadeias leves que, ao se alterar diminuem a contratilidade. No remodelamento o transporte do cálcio através do retículo sarcoplasmático (canais de cálcio) encontra-se reduzido durante a sístole e aumentado durante a diástole. Como consequência temos mudanças da geometria (de forma elíptica para esférica) e da espessura das paredes, com diminuição da contratilidade e da rotação e torção miocárdicas e perda de eficiência mecânica sistólica (nos modelos de isquemia) e diastólica (em todas as formas de injúria). Com relação à ativação neuro-hormonal, no remodelamento estão envolvidos o sistema simpático e o sistema renina-angiotensina-aldosterona. A ativação de ambos os sistemas estimula a síntese de proteínas em miócitos e fibroblastos causando hipertrofia ventricular e fibrose.
As consequências resultam, em primeiro lugar, em disfunção cardíaca subclínica, que pode ser detectada pela diminuição do strain longitudinal global e pela alteração da função diastólica; segue a fase de disfunção clínica, com diminuição da fração de ejeção, dilatação da cavidade e adelgaçamento das paredes (nas formas dilatadas) ou espessamento das paredes com relativa manutenção da fração de ejeção (nas formas hipertróficas). A agressão direta aos miócitos (cardiotoxicidade, miocardites) provoca diminuição da contratilidade com pouco aumento dos diâmetros ventriculares e alterações na função diastólica.
A identificação de preditores confiáveis de remodelamento permite adotar uma abordagem terapêutica adequada para cada tipo de injúria, um seguimento mais detalhado e uma planificação mais eficiente da terapia para pacientes com maior risco de dilatação progressiva do VE e declínio da fração de ejeção e, vice-versa, para aqueles pacientes que apresentam menor risco.